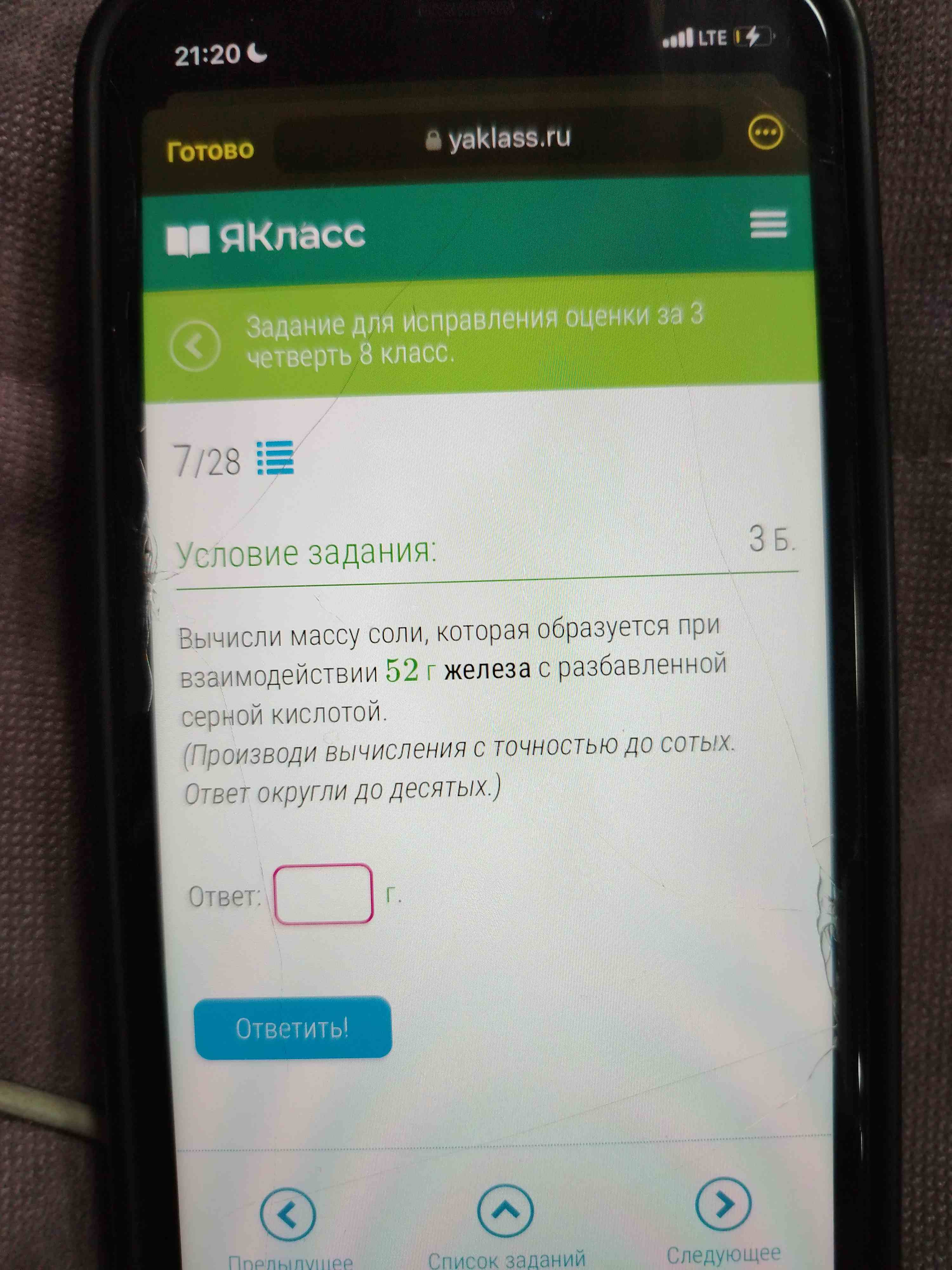
Вычисли массу соли, которая образуется при взаимодействии 52 г железа с разбавленной серной кислотой. (Производи вычисления с точностью до сотых. Ответ округли до десятых.)
Ответ:
Для решения этой задачи нам понадобится уравнение реакции взаимодействия железа с серной кислотой и знание молярных масс веществ.
- Запишем уравнение реакции:
- Найдем молярную массу железа (Fe):
- Найдем количество вещества железа (Fe):
- Определим количество вещества сульфата железа(II) (FeSO4):
- Найдем молярную массу сульфата железа(II) (FeSO4):
- Вычислим массу сульфата железа(II) (FeSO4):
- Округлим ответ до десятых:
Железо (Fe) реагирует с серной кислотой (H2SO4) с образованием сульфата железа(II) (FeSO4) и водорода (H2).
$$Fe + H_2SO_4 \rightarrow FeSO_4 + H_2$$
Молярная масса железа (Fe) составляет приблизительно 55.845 г/моль.
$$M(Fe) = 55.845 \frac{г}{моль}$$
Дано 52 г железа. Чтобы найти количество вещества, разделим массу на молярную массу.
$$n(Fe) = \frac{m(Fe)}{M(Fe)} = \frac{52 г}{55.845 \frac{г}{моль}} \approx 0.931 моль$$
Согласно уравнению реакции, на 1 моль железа образуется 1 моль сульфата железа(II). Следовательно,
$$n(FeSO_4) = n(Fe) \approx 0.931 моль$$
Молярная масса FeSO4 = M(Fe) + M(S) + 4 * M(O) = 55.845 + 32.06 + 4 * 16 = 151.905 г/моль
$$M(FeSO_4) = 151.905 \frac{г}{моль}$$
$$m(FeSO_4) = n(FeSO_4) * M(FeSO_4) = 0.931 моль * 151.905 \frac{г}{моль} \approx 141.42 г$$
Округляем 141.42 до десятых, получаем 141.4 г.
Ответ: 141.4 г